Figure below shows two paths that may be taken by a gas to go from a state A to a state C. In process AB, 400 J of heat is added to the system and in process BC, 100 J of heat is added to the system. The heat absorbed by the system in the process AC will be-

1. 380 J
2. 500 J
3. 460 J
4. 300 J
नीचे दी गई आकृति में दो पथों को दिखाया गया है जो गैस द्वारा अवस्था A से अवस्था C तक जाने में लिए जा सकते हैं। प्रक्रम AB में, निकाय में 400 J ऊष्मा अवशोषित की जाती है और प्रक्रम BC में, निकाय में 100 J ऊष्मा अवशोषित की जाती है। प्रक्रम AC में निकाय द्वारा अवशोषित ऊष्मा होगी-

1. 380 J
2. 500 J
3. 460 J
4. 300 J

1. 380 J
2. 500 J
3. 460 J
4. 300 J

1. 380 J
2. 500 J
3. 460 J
4. 300 J
A given mass of gas expands from state A to state B by three paths 1,2 and 3 as shown in the figure. If respectively be the work done by the gas along the three paths then
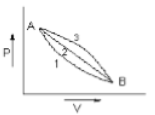
1.
2.
3.
4.
जैसा कि आकृति में दिखाया गया है एक गैस का दिया हुआ द्रव्यमान अवस्था A से अवस्था B तक तीन पथों 1,2 और 3 द्वारा प्रसारित होता है। यदि , और क्रमशः गैस द्वारा तीन पथों के अनुदिश किए जाने वाले कार्य हैं, तब :
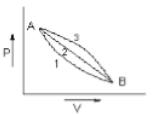
1.
2.
3.
4.
In given process dW = 0, dQ < 0 then for a gas
1. Temperature - increases
2. Volume - decreases
3. Pressure - decreases
4. Pressure - increases
एक दिए गए प्रक्रम मे dW = 0, dQ < 0, तब गैस के लिए,
1. तापमान बढ़ता है
2. आयतन घटता है
3. दाब घटता है
4. दाब बढ़ता है
A system is taken from state A to state B along two different paths 1 and 2. If the heat absorbed and work done by the system along these two paths are respectively, then
(1)
(2)
(3)
(4)
एक निकाय को अवस्था A से अवस्था B तक दो अलग-अलग पथों 1 और 2 के अनुदिश लाया जाता है। यदि इन दो पथों के अनुदिश अवशोषित ऊष्मा और निकाय द्वारा किया गया कार्य क्रमशः है, तब,
(1)
(2)
(3)
(4)
The volume of air increases by 5% in its adiabatic expansion. The percentage decrease in its pressure will be -
(1) 5%
(2) 6%
(3) 7%
(4) 8%
किसी रुद्धोष्म प्रसार में वायु का आयतन 5% बढ़ जाता है। इसके दाब में प्रतिशत कमी होगी -
(1) 5%
(2) 6%
(3) 7%
(4) 8%
When an ideal gas (γ = 5/3) is heated under constant pressure, then what percentage of given heat energy will be utilised in doing external work ?
(1) 40 %
(2) 30 %
(3) 60 %
(4) 20 %
जब एक आदर्श गैस (γ = 5/3) को नियत दाब पर गर्म किया जाता है, तब दी गई ऊष्मीय ऊर्जा का कितना प्रतिशत बाह्य कार्य करने में उपयोग किया जाएगा?
(1) 40 %
(2) 30 %
(3) 60 %
(4) 20 %
If ΔQ and ΔW represent the heat supplied to the system and the work done on the system respectively, then the first law of thermodynamics can be written as
(1) ΔQ = ΔU + ΔW
(2) ΔQ = ΔU – ΔW
(3) ΔQ = ΔW – ΔU
(4) ΔQ = –ΔU – ΔW
where ΔU is the internal energy
यदि ΔQ और ΔW क्रमशः निकाय को आपूर्ति की गयी ऊष्मा और निकाय पर किए गए कार्य को प्रदर्शित करते हैं, तब ऊष्मागतिकी के प्रथम नियम को निम्न प्रकार से लिखा जा सकता है:
(1) ΔQ = ΔU + ΔW
(2) ΔQ = ΔU – ΔW
(3) ΔQ = ΔW – ΔU
(4) ΔQ = –ΔU – ΔW
जहाँ ΔU आंतरिक ऊर्जा है
Helium at 27°C has a volume of 8 litres. It is suddenly compressed to a volume of 1 litre. The temperature of the gas will be [γ = 5/3]
(1) 108°C
(2) 9327°C
(3) 1200°C
(4) 927°C
27°C ताप पर हीलियम का आयतन 8 लीटर है। यह अचानक 1 लीटर के आयतन मे संपीडित हो जाती है। गैस का तापमान होगा: [γ = 5/3]
(1) 108°C
(2) 9327°C
(3) 1200°C
(4) 927°C
A Carnot engine working between 300 K and 600K has work output of 800 J per cycle. What is amount of heat energy supplied to the engine from source per cycle ?
(1) 1800 J/cycle
(2) 1000 J/cycle
(3) 2000 J/cycle
(4) 1600 J/cycle
300 K और 600 K के बीच कार्य करने वाला एक कार्नो इंजन प्रति चक्र 800 J कार्य निर्गत करता है। प्रति चक्र स्रोत से इंजन को आपूर्ति की जाने वाली ऊष्मा ऊर्जा की मात्रा कितनी है?
(1) 1800 J/cycle
(2) 1000 J/cycle
(3) 2000 J/cycle
(4) 1600 J/cycle
First law of thermodynamics is a special case of
(1) Newton's law
(2) Law of conservation of energy
(3) Charle's law
(4) Law of heat exchange
ऊष्मागतिकी का प्रथम नियम निम्न की एक विशेष स्थिति है:
(1) न्यूटन का नियम
(2) ऊर्जा संरक्षण का नियम
(3) चार्ल्स का नियम
(4) ऊष्मा विनिमय का नियम






