An ideal gas is taken from point A to the point B, as shown in the P-V diagram. The work done in the process is -

1.
2.
3.
4.
एक आदर्श गैस को बिंदु A से बिंदु B तक ले जाया जाता है, जैसा कि P-V आरेख में दिखाया गया है। प्रक्रम में किया गया कार्य है:

1.
2.
3.
4.


An ideal gas A and a real gas B have their volumes increased from V to 2 V under isothermal conditions. The increase in internal energy
(1) Will be same in both A and B
(2) Will be zero in both the gases
(3) Of B will be more than that of A
(4) Of A will be more than that of B
एक आदर्श गैस A और एक वास्तविक गैस B के आयतन V से 2V तक समतापीय स्थितियों के अंतर्गत बढ़ाये जाते हैं। आंतरिक ऊर्जा में वृद्धि :
(1) A और B दोनों में समान होगी
(2) दोनों गैसों में शून्य होगी
(3) B की A से अधिक होगी
(4) A की B से अधिक होगी
A Container having 1 mole of a gas at a temperature 27°C has a movable piston which maintains constant pressure in container of 1 atm. The gas is compressed until temperature becomes 127°C. The work done is (Cp for gas is 7.03 cal/mol K)
(1) 703 J
(2) 814 J
(3) 121 J
(4) 2035 J
एक बर्तन मे 1 मोल गैस 27°C ताप पर भरी गई है। यह गैस एक मुक्त पिस्टन से परिबद्ध है जो बर्तन मे 1 atm नियत दाब बनाये रखता है। गैस को संपीडित किया जाता है जब तक तापमान 127°C हो जाता है। किया गया कार्य है (गैस के लिए Cp 7.03 cal/mol Kहै)
(1) 703 J
(2) 814 J
(3) 121 J
(4) 2035J
Work done by a system under isothermal change from a volume V1 to V2 for a gas which obeys Vander Waal's equation
(1)
(2)
(3)
(4)
एक गैस के लिए V1 आयतन से V2 तक समतापी परिवर्तन के तहत एक निकाय द्वारा किया गया कार्य जिसमे गैस वान्डर वाल्स के समीकरण का पालन करती है
(1)
(2)
(3)
(4)
P-V diagram of a diatomic gas is a straight line passing through origin. The molar heat capacity of the gas in the process will be -
1. 4 R
2. 2.5 R
3. 3 R
4.
किसी द्विपरमाणुक गैस के लिए P-V आरेख मूलबिंदु से गुजरने वाली एक सरल रेखा है। इस प्रक्रम में गैस की मोलर ऊष्मा धारिता होगी -
(1) 4R
(2) 2.5R
(3) 3R
(4)
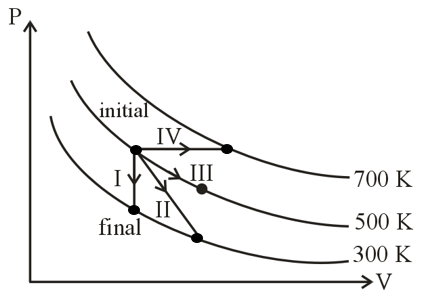
Match the following
Column-I Column-II
P. Process I a. Adiabatic
Q. Process II b. Isobaric
R. Process III c. Isochoric
S. Process IV d. Isothermal

निम्नलिखित का मिलान कीजिए
स्तम्भ-I स्तंभ-II
P. प्रक्रम I रुद्धोष्म
Q. प्रक्रम II समदाबीय
R. प्रक्रम III समआयतनिक
S. प्रक्रम IV समतापीय
In the following P-V diagram two adiabatics cut two isothermals at temperatures T1 and T2 (fig.). The value of will be
(1)
(2)
(3)
(4) VbVc
निम्नलिखित P-V आरेख में दो रुद्धोष्म वक्र तापमान T1 और T2 (आकृति) पर दो समतापी वक्रों को काटते हैं। का मान होगा :
(1)
(2)
(3)
(4) VbVc
In pressure-volume diagram given below, the isochoric, isothermal, and isobaric parts respectively are -
(1) BA, AD, DC
(2) DC, CB, DA
(3) AB, BC, CD
(4) CD, DA, AB
नीचे दिए गए दाब-आयतन आरेख में क्रमशः समआयतनिक, समतापीय और समदाबी भाग हैं: -
(1) BA, AD, DC
(2) DC, CB, DA
(3) AB, BC, CD
(4) CD, DA, AB
Four curves A, B, C and D are drawn in the adjoining figure for a given amount of gas. The curves which represent adiabatic and isothermal changes are -
(1) C and D respectively
(2) D and C respectively
(3) A and B respectively
(4) B and A respectively
गैस की दी गई मात्रा के लिए चार वक्र A, B, C और D संलग्न आकृति में खींचे गए है। वक्र जो रूद्धोष्म और समतापी परिवर्तनों को प्रदर्शित करते हैं -
(1) C और D क्रमश:
(2) D और C क्रमश:
(3) A और B क्रमश:
(4) B और A क्रमश:
The specific heat at constant pressure and at constant volume for an ideal gas are and and its adiabatic and isothermal elasticities are and respectively. The ratio of to is
(a)
(b)
(c)
(d)
एक आदर्श गैस के लिए नियत दाब और नियत आयतन पर विशिष्ट उष्मायें क्रमश: और है और इसकी रूद्धोष्म और समतापीय प्रत्यास्थताएँ क्रमशः और हैं। से का अनुपात ज्ञात कीजिए:
(a)
(b)
(c)
(d)









