In the figure given two processes A and B are shown by which a thermo-dynamical system goes from initial to final state F. If ΔQA and ΔQB are respectively the heats supplied to the systems then

(1) ΔQA = ΔQB
(2)
(3) ΔQA < ΔQB
(4) ΔQA > ΔQB
चित्र में दो प्रक्रम A और B दर्शाए गए हैं जिनके द्वारा एक ऊष्मागतिक निकाय प्रारंभ से अंतिम स्थिति F में जाता है। यदि ΔQA और ΔQB क्रमशः निकाय को दी गयी ऊष्माएँ है तब

(1) ΔQA = ΔQB
(2)
(3) ΔQA < ΔQB
(4) ΔQA > ΔQB


A refrigerator works between 4°C and 30°C. It is required to remove 600 calories of heat every second in order to keep the temperature of the refrigerated space constant. The power required is (Take, 1 cal = 4.2 Joules)
(a)23.65W
(b)236.5W
(c)2365W
(d)2.365W
एक फ्रिज 4°C और 30°C के बीच कार्य करता है। इसे प्रशीतित स्थान के तापमान को नियत रखने के लिए
प्रत्येक सेकंड 600 कैलोरी ऊष्मा को निष्काषित करना आवश्यक है। आवश्यक शक्ति है (1 कैलोरी = 4.2 जूल लीजिए)
(a) 23.65W
(b) 236.5W
(c) 2365W
(d) 2.365W
A thermodynamic system is taken through the cycle ABCD as shown in figure. Heat rejected by the gas during the cycle is
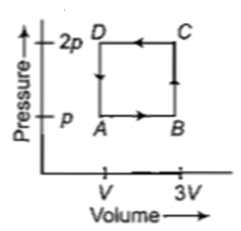
(a)2 pV (b)4 pV
(c) (d)pV
चित्र में दिखाए अनुसार एक ऊष्मागतिकी निकाय चक्र ABCD के माध्यम से लाया गया है। चक्र के दौरान गैस द्वारा निष्काषित ऊष्मा है:
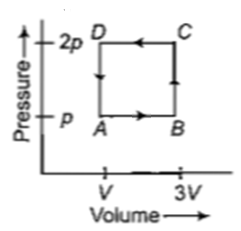
(a) 2 pV (b) 4 pV
(c) (d) pV
The coefficient of performance of a refrigerator is 5. If the temperature inside freezer is -20°C, the temperature of the surroundings to which it rejects heat is -
| 1. | 31°C | 2. | 41°C |
| 3. | 11°C | 4. | 21°C |
एक प्रशीतक/रेफ्रिजरेटर का निष्पादन गुणांक 5 है। यदि फ्रीजर के अंदर का तापमान -20°C है, वातावरण का तापमान, जिसमे वह ऊष्मा को बहिष्कृत करता है, है -
| 1. | 31 °C | 2. | 41 °C |
| 3. | 11 °C | 4. | 21 °C |
If represent the increase in internal energy and work done by the system respectively in a thermodynamical process,which of the following is true?
(a) in a adiabatic process
(b) in a isothermal process
(c) in adiabatic process
(d) in a isothermal process
यदि एक ऊष्मागतिकीय प्रक्रम में क्रमशः आंतरिक ऊर्जा में वृद्धि और निकाय द्वारा किए गए कार्य को प्रदर्शित करते हैं, निम्नलिखित में से कौन सा सत्य है?
(a) रुद्धोष्म प्रक्रम में
(b) समतापी प्रक्रम में
(c) रुद्धोष्म प्रक्रम में
(d) समतापी प्रक्रम में
In the diagrams (i) to (iv) , variation of volume with changing pressure is shown. A gas is taken along the path ABCDA. The change in internal energy of the gas will be
(1) Positive in all cases (i) to (iv)
(2) Positive in cases (i), (ii) and (iii) but zero in (iv) case
(3) Negative in cases (i), (ii) and (iii) but zero in (iv) case
(4) Zero in all four cases
आरेख (i) से (iv) में, परिवर्तित होते हुए दाब के साथ आयतन के परिवर्तन को दर्शाया गया है। पथ ABCD के अनुदिश एक गैस ले जाई जाती है। गैस की आंतरिक ऊर्जा में परिवर्तन होगा:
(1) (i) से (iv) तक सभी स्थितियों में धनात्मक
(2) (i), (ii) और (iii) स्थितियों में धनात्मक लेकिन (iv) स्थिति में शून्य
(3) (i), (ii) और (iii) स्थितियों में ऋणात्मक लेकिन (iv) स्थिति में शून्य
(4) सभी चारों स्थितियों में शून्य
A system performs work ΔW when an amount of heat is ΔQ added to the system, the corresponding change in the internal energy is ΔU. A unique function of the initial and final states (irrespective of the mode of change) is -
(1) ΔQ
(2) ΔW
(3) ΔU and ΔQ
(4) ΔU
एक निकाय ΔW कार्य करता है जब ऊष्मा की मात्रा ΔQ को निकाय में प्रवाहित किया जाता है, आंतरिक ऊर्जा में सम्बंधित परिवर्तन ΔU है। प्रारंभिक और अंतिम अवस्थाओं (परिवर्तन की विधि के निरपेक्ष) का एकमात्र फलन है
(1) ΔQ
(2) ΔW
(3) ΔU और ΔQ
(4) ΔU
A monoatomic gas of n-moles is heated from temperature T1 to T2 under two different conditions (i) at constant volume and (ii) at constant pressure. The change in internal energy of the gas is
(1) More for (i)
(2) More for (ii)
(3) Same in both cases
(4) Independent of number of moles
n-मोल की एकपरमाणुक गैस को दो अलग-अलग स्थितियों में (i) नियत आयतन पर और (ii) नियत दाब पर तापमान T1 से T2 तक गर्म किया जाता है। गैस की आंतरिक ऊर्जा में परिवर्तन:
(1) (i) के लिए अधिक होता है
(2) (ii) के लिए अधिक होता है
(3) दोनों स्थितियों में समान होता है
(4) मोलों की संख्या से स्वतंत्रहोता है
A vessel containing 5 litres of a gas at 0.8 m pressure is connected to an evacuated vessel of volume 3 litres. The resultant pressure inside will be (assuming whole system to be isolated)
(1) 4/3 m
(2) 0.5 m
(3) 2.0 m
(4) 3/4 m
0.8 m दाब पर 5 लीटर गैस से भरे एक बर्तन को 3 लीटर आयतन के खाली बर्तन से जोड़ा जाता है। आंतरिक परिणामी दाब होगा (पूरे निकाय को विलगित मानकर) :
(1) 4/3 m
(2) 0.5 m
(3) 2.0 m
(4) 3/4 m
Initial pressure and volume of a gas are P and V respectively. First it is expanded isothermally to volume 4V and then compressed adiabatically to volume V. The final pressure of gas will be [Given : -
(1) 1P
(2) 2P
(3) 4P
(4) 8P
किसी गैस का प्रारंभिक दाब और आयतन क्रमशः P और V है। पहले इसे समतापी विधि से आयतन 4V तक प्रसारित किया जाता है और फिर रूद्धोष्म विधि से आयतन V तक संपीडित किया जाता है। गैस का अंतिम दाब होगा। [दिया गया है: -
(1) 1P
(2) 2P
(3) 4P
(4) 8P







