For a reversible process, necessary condition is -
(1) In the whole cycle of the system, the loss of any type of heat energy should be zero
(2) That the process should be too fast
(3) That the process should be slow so that the working substance should remain in thermal and mechanical equilibrium with the surroundings
(4) The loss of energy should be zero and it should be quasistatic
एक उत्क्रमणीय प्रक्रम के लिए, आवश्यक स्थिति है -
(1) निकाय के पूरे चक्र में, किसी भी प्रकार की ऊष्मीय ऊर्जा का ह्रास शून्य होना चाहिए
(2) यह प्रक्रम बहुत तीव्र होना चाहिए
(3) यह प्रक्रिया धीमी होनी चाहिए ताकि कार्यकारी पदार्थ वातावरण के साथ ऊष्मीय और यांत्रिक साम्यावस्था में बना रहे
(4) ऊर्जा का ह्रास शून्य होना चाहिए और यह स्थैतिककल्प होना चाहिए
In the following figures, four curves A, B, C and D are shown. The curves are
1. Isothermal for A and D while adiabatic for B and C
2. Adiabatic for A and C while isothermal for B and D
3. Isothermal for A and B while adiabatic for C and D
4. Isothermal for A and C while adiabatic for B and D
निम्नलिखित आरेखों में, चार वक्र A, B, C और D दर्शाए गए हैं। वक्र हैं:
(1) A और D के लिए समतापीय जबकि B और C के लिए रुद्धोष्म
(2) A और C के लिए रुद्धोष्म जबकि B और D के लिए समतापीय
(3) A और B के लिए समतापीय जबकि C और D के लिए रुद्धोष्म
(4) A और C के लिए समतापीय जबकि B और D के लिए रुद्धोष्म
Figure below shows two paths that may be taken by a gas to go from a state A to a state C. In process AB, 400 J of heat is added to the system and in process BC, 100 J of heat is added to the system. The heat absorbed by the system in the process AC will be-
(a) 380 J
(b) 500 J
(c) 460 J
(d) 300 J
नीचे दी गई आकृति में दो पथों को दिखाया गया है जो गैस द्वारा अवस्था A से अवस्था C तक जाने में लिए जा सकते हैं। प्रक्रम AB में, निकाय में 400 J ऊष्मा अवशोषित की जाती है और प्रक्रम BC में, निकाय में 100 J ऊष्मा अवशोषित की जाती है। प्रक्रम AC में निकाय द्वारा अवशोषित ऊष्मा होगी-
(a) 380 J
(b) 500 J
(c) 460 J
(d) 300 J
A given mass of gas expands from state A to state B by three paths 1,2 and 3 as shown in the figure. If respectively be the work done by the gas along the three paths then
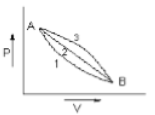
1.
2.
3.
4.
जैसा कि आकृति में दिखाया गया है एक गैस का दिया हुआ द्रव्यमान अवस्था A से अवस्था B तक तीन पथों 1,2 और 3 द्वारा प्रसारित होता है। यदि , और क्रमशः गैस द्वारा तीन पथों के अनुदिश किए जाने वाले कार्य हैं, तब :
1.
2.
3.
4.
In given process dW = 0, dQ < 0 then for a gas
1. Temperature - increases
2. Volume - decreases
3. Pressure - decreases
4. Pressure - increases
एक दिए गए प्रक्रम मे dW = 0, dQ < 0, तब गैस के लिए,
1. तापमान बढ़ता है
2. आयतन घटता है
3. दाब घटता है
4. दाब बढ़ता है
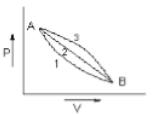
A system is taken from state A to state B along two different paths 1 and 2. If the heat absorbed and work done by the system along these two paths are respectively, then
(1)
(2)
(3)
(4)
एक निकाय को अवस्था A से अवस्था B तक दो अलग-अलग पथों 1 और 2 के अनुदिश लाया जाता है। यदि इन दो पथों के अनुदिश अवशोषित ऊष्मा और निकाय द्वारा किया गया कार्य क्रमशः है, तब,
(1)
(2)
(3)
(4)
The volume of air increases by 5% in its adiabatic expansion. The percentage decrease in its pressure will be -
(1) 5%
(2) 6%
(3) 7%
(4) 8%
किसी रुद्धोष्म प्रसार में वायु का आयतन 5% बढ़ जाता है। इसके दाब में प्रतिशत कमी होगी -
(1) 5%
(2) 6%
(3) 7%
(4) 8%
When an ideal gas (γ = 5/3) is heated under constant pressure, then what percentage of given heat energy will be utilised in doing external work ?
(1) 40 %
(2) 30 %
(3) 60 %
(4) 20 %
जब एक आदर्श गैस (γ = 5/3) को नियत दाब पर गर्म किया जाता है, तब दी गई ऊष्मीय ऊर्जा का कितना प्रतिशत बाह्य कार्य करने में उपयोग किया जाएगा?
(1) 40 %
(2) 30 %
(3) 60 %
(4) 20 %
If ΔQ and ΔW represent the heat supplied to the system and the work done on the system respectively, then the first law of thermodynamics can be written as
(1) ΔQ = ΔU + ΔW
(2) ΔQ = ΔU – ΔW
(3) ΔQ = ΔW – ΔU
(4) ΔQ = –ΔU – ΔW
where ΔU is the internal energy
यदि ΔQ और ΔW क्रमशः निकाय को आपूर्ति की गयी ऊष्मा और निकाय पर किए गए कार्य को प्रदर्शित करते हैं, तब ऊष्मागतिकी के प्रथम नियम को निम्न प्रकार से लिखा जा सकता है:
(1) ΔQ = ΔU + ΔW
(2) ΔQ = ΔU – ΔW
(3) ΔQ = ΔW – ΔU
(4) ΔQ = –ΔU – ΔW
जहाँ ΔU आंतरिक ऊर्जा है
Helium at 27°C has a volume of 8 litres. It is suddenly compressed to a volume of 1 litre. The temperature of the gas will be [γ = 5/3]
(1) 108°C
(2) 9327°C
(3) 1200°C
(4) 927°C
27°C ताप पर हीलियम का आयतन 8 लीटर है। यह अचानक 1 लीटर के आयतन मे संपीडित हो जाती है। गैस का तापमान होगा: [γ = 5/3]
(1) 108°C
(2) 9327°C
(3) 1200°C
(4) 927°C






